Dãy hoạt động hóa học của kim loại hay còn gọi là chuỗi phản ứng, đề cập đến sự sắp xếp của các kim loại theo thứ tự giảm dần khả năng phản ứng của chúng.
Dãy hoạt động hóa học của kim loại có thể được sử dụng để dự đoán liệu một kim loại có thể chuyển vị khác trong một phản ứng chuyển vị đơn lẻ hay không. Nó cũng có thể được sử dụng để thu thập thông tin về khả năng phản ứng của kim loại đối với nước và axit.

Tính Năng Nổi Bật Của Kim Loại
- Các kim loại ở đầu dãy phản ứng là chất khử mạnh vì chúng dễ bị oxi hóa. Những kim loại này rất dễ bị xỉn màu / ăn mòn.
- Khả năng khử của các kim loại tăng dần khi theo chiều dọc của dãy.
- Độ dương điện của các nguyên tố cũng giảm trong khi di chuyển xuống dãy phản ứng của kim loại.
- Tất cả các kim loại được tìm thấy ở trên với hiđro trong dãy hoạt động đều giải phóng khí H2 khi phản ứng với HCl loãng hoặc H2SO4 loãng .
- Kim loại xếp cao hơn trong dãy phản ứng có khả năng dịch chuyển kim loại xếp thấp hơn khỏi dung dịch muối của chúng.
- Các kim loại xếp hạng cao hơn đòi hỏi lượng năng lượng lớn hơn để phân lập chúng khỏi quặng và các hợp chất khác.
Một đặc điểm quan trọng khác của chuỗi hoạt động là trong khi đi xuống chuỗi, khả năng tặng electron của các kim loại giảm.
Dãy Hoạt Động Hóa Học Của Kim Loại Dạng Bảng
Khả năng phản ứng của các kim loại được lập bảng dưới đây (theo thứ tự giảm dần) cùng với các ion tương ứng của chúng. Lưu ý rằng các kim loại màu đỏ phản ứng với nước. Các kim loại màu da cam không phản ứng với nước nhưng có thể phản ứng với axit. Và các kim loại màu xanh chỉ phản ứng với một số axit có tính oxi hóa mạnh.
| Chuỗi phản ứng của kim loại | Ions hình thành |
| Cesium | Cs + |
| Francium | Fr + |
| Rubidi | Rb + |
| Kali | K + |
| Natri | Na + |
| Lithium | Li + |
| Bari | Ba 2+ |
| Đường bán kính | Ra 2+ |
| Stronti | Sr 2+ |
| Canxi | Ca 2+ |
| Magiê | Mg 2+ |
| Nhôm | Al 3+ |
| Titan | Ti 4+ |
| Mangan | Mn 2+ |
| Kẽm | Zn 2+ |
| Chromium | Cr 3+ |
| Sắt | Fe 3+ |
| Cadmium | Cd 2+ |
| Coban | Co 2+ |
| Niken | Ni 2+ |
| Tin | Sn 2+ |
| Chỉ huy | Pb 2+ |
| Hydrogen | H + (Phi kim loại, Tham khảo để so sánh) |
| Antimon | Sb 3+ |
| Bismuth | Bi 3+ |
| Đồng | Cu 2+ |
| Vonfram | W 3+ |
| thủy ngân | Hg 2+ |
| Bạc | Ag + |
| Bạch kim | Pt 4+ |
| Vàng | Au 3+ |
Mặc dù là một phi kim loại, hydro thường được bao gồm trong chuỗi phản ứng vì nó giúp so sánh khả năng phản ứng của các kim loại. Các kim loại xếp trên hiđro trong dãy có thể thay thế nó khỏi axit như HCl và H2SO4 (vì chúng phản ứng mạnh hơn).
Mẹo Học Thuộc Dãy Hoạt Động Hóa Học Của Kim Loại

Một số mẹo dùng để học thuộc dãy hoạt động hóa học của kim loại
- K, Ca, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au
- Khi cần nàng may áo giáp sắt nhớ sang phố hỏi cửa hàng Á Phi Âu
- Khi cả nhà may áo giáp sắt nhớ sang phố hàn đồng hiệu Á Phi Âu
- Li, K, Ba, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb, (H), Cu, Hg, Ag, Pt, Au
- Lúc khó bà cần nàng may áo màu giáp có sắt nhớ sang phố hàn đồng hiệu Á Phi Âu
Những Công Dụng Quan Trọng Của Chuỗi Hoạt Động
Ngoài việc cung cấp cái nhìn sâu sắc về các tính chất và khả năng phản ứng của các kim loại, dãy hoạt động hóa học của kim loại còn có một số ứng dụng quan trọng khác. Ví dụ, kết quả của các phản ứng giữa kim loại và nước, kim loại và axit. Phản ứng hữu cơ giữa các kim loại có thể được dự đoán với sự trợ giúp của chuỗi hoạt động.
Phản ứng giữa kim loại và nước
Canxi và các kim loại có khả năng phản ứng mạnh hơn canxi trong dãy phản ứng có thể phản ứng với nước lạnh tạo thành hiđroxit tương ứng đồng thời giải phóng khí hiđro. Ví dụ, phản ứng giữa kali và nước tạo ra kali hydroxit và khí H2 , như được mô tả bằng phương trình hóa học dưới đây.
2K + 2H2O → 2KOH + H2
Do đó, dãy số phản ứng của kim loại có thể dùng để dự đoán phản ứng giữa kim loại và nước.
Phản ứng giữa kim loại và axit
Chì và các kim loại xếp ở trên dẫn đầu trong dãy hoạt động tạo thành muối khi phản ứng với axit clohydric hoặc axit sunfuric. Những phản ứng này cũng liên quan đến việc giải phóng khí hydro. Phản ứng giữa kẽm và axit sunfuric là một ví dụ về phản ứng như vậy. Tại đây, kẽm sunfat và khí H2 được tạo thành sản phẩm. Phương trình hóa học là:
Zn + H2SO4 → ZnSO4 + H2
Do đó, các phản ứng giữa kim loại và một số axit có thể được dự đoán với sự trợ giúp của chuỗi phản ứng.
Do kim loại có phản ứng với axit và nước, một số vật dụng, thiết bị được làm từ kim loại thường bị han rỉ, hư hỏng sau một thời gian. Bán những vật dụng kim loại đã hỏng cho đơn vị thu mua phế liệu là một lựa chọn giúp bạn tiết kiệm được chi phí.
Các phản ứng chuyển vị giữa các kim loại
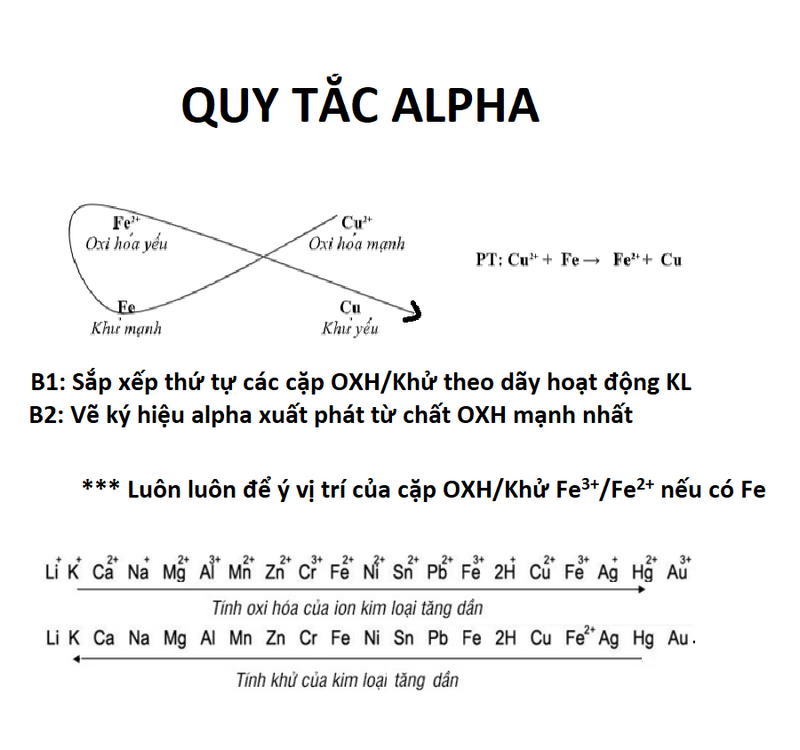
Các ion của kim loại xếp hạng thấp dễ dàng bị khử bởi các kim loại xếp hạng cao trên dãy phản ứng. Do đó, các kim loại xếp hạng thấp dễ bị các kim loại xếp hạng cao thay thế trong các phản ứng chuyển vị giữa chúng.
Một ví dụ tuyệt vời của phản ứng như vậy là sự chuyển vị của đồng từ đồng sunfat bằng kẽm. Phương trình hóa học của phản ứng này được cho bởi:
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Khái niệm này có một số ứng dụng thực tế trong việc khai thác kim loại. Ví dụ, titan được chiết xuất từ titan tetraclorua thông qua một phản ứng chuyển vị duy nhất với magie. Do đó, dãy phản ứng của các kim loại cũng có thể được sử dụng để dự đoán kết quả của các phản ứng chuyển đơn.
Các Câu Hỏi Thường Gặp
Dãy hoạt động hóa học thể hiện điều gì?
Theo thứ tự phản ứng dãy phản ứng có các kim loại. Khả năng phản ứng của kim loại có thể được xác định bằng cách nghiên cứu các phản ứng của nó trong cả phản ứng cạnh tranh và chuyển vị.
Kim loại nào ít phản ứng nhất?
Các nguyên tố trong bảng tuần hoàn được gọi là kim loại chuyển tiếp ít phản ứng hơn nhiều, và các kim loại như vàng và bạch kim xếp cuối danh sách, thể hiện ít hơn trong cách phản ứng hóa học với bất kỳ thuốc thử thông thường nào.
Khả năng phản ứng của kim loại là gì?
Trình tự phản ứng kim loại, còn được gọi là tập hợp các hoạt động, đề cập đến tổ chức của kim loại theo thứ tự tăng dần của hoạt động phản ứng của chúng. … Các kim loại có xu hướng mất electron và hình thành các cation một cách nhanh chóng. Một số dẫn đến sự hình thành các oxit kim loại với oxy xung quanh.
Nguyên tố nào phản ứng mạnh nhất?
Nhóm cơ bản phản ứng mạnh nhất là các kim loại kiềm (nằm cách xa các kim loại trung gian và khí quý). Cesium đứng thứ hai từ cuối nhóm này, có 6 lớp vỏ electron, và nó phù hợp với các tính năng của một nguyên tử phản ứng, khiến nó trở thành nguyên tố phản ứng mạnh nhất.
Các phi kim loại Có phản ứng hay không phản ứng?
Tính chất phi kim loại có nhiệt độ sôi tương đối thấp, còn các phi kim loại khác là chất khí. Tương tự như vậy, phi kim loại là chất dẫn nhiệt kém, còn phi kim loại rắn thì xỉn màu và giòn. Nhiều phi kim loại phản ứng mạnh, trong khi những phi kim loại khác không phản ứng. Nó phụ thuộc vào số lượng electron trong số lượng năng lượng bên ngoài.





































![[GÓC TUYỂN DỤNG] VDO Tuyển Dụng 04 Nhân Viên Kinh Doanh Dữ Liệu Trực Tuyến](https://thumuaphelieu247.vn/wp-content/uploads/2019/08/tuyen-nhan-su.jpg)